
BSA 단백질에 측정된 아미노산 Tryptophan 내부 형광의 온도에 따른 스펙트럼 변화는 그림 7.과 같다.
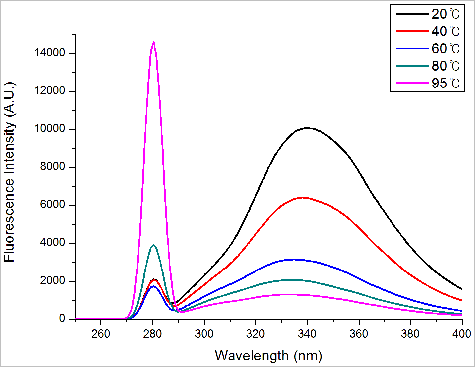
그림 7. BSA 단백질의 온도에 따른 Tryptophan의 형광 변화
측정된 단백질들의 내부 형광의 변화량을 Y축, 온도를 X축으로 표시하는 Thermal 모드에서 데이터는 그림 8과 같다. 형광 변화의 절대값이 최대인 지점을 구하는 Derivative 방식으로 계산된 단백질의 Tm 값은 BSA는 65도, Catalase는 45도 Hemoglobin은 50도로 계산되었다. 이를 통하여 열적 안정성은 BSA > Hemoglobin > Catalase 순으로 높음을 확인 할 수 있다.
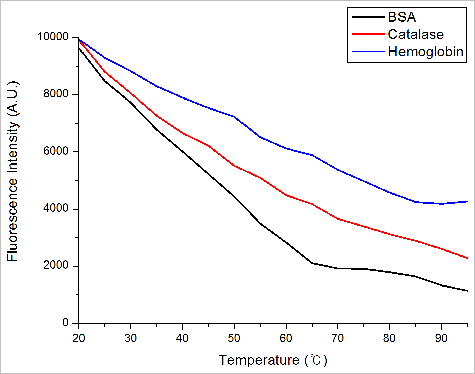
그림 8. 단백질들의 온도에 따른 Tryptophan의 형광 변화
또 다른 열적 안정성 측정 방식인 직각산란광의 온도에 따른 변화는 그림 9.과 같다. 직각산란광의 경우 급격한 Intensity 변화 시작점과 종료점의 중간을 Tagg로 잡아 계산하였다. 이를 통해 계산된 단백질의 Tagg의 값은 BSA는 85도, Catalase는 50도, Hemoglobin은 52.5도로 계산되었다. 직각산란광을 통한 열적안정성 역시 BSA > Hemoglobin > Catalase 순으로 높음을 확인 할 수 있다.
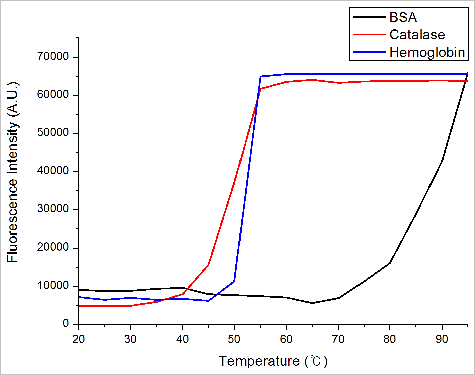
그림 9. 단백질들의 온도에 따른 RALS 값 변화

본 실험에서는 ㈜신코의 형광 분광광도계 FS-2와 Peltier System 악세사리를 이용하여 온도에 따른 단백질의 형광과 직각산란광의 변화를 살펴보았다. 이를 토대로 용액상태의 단백질들의 열적안정성을 손쉽고 신뢰성 있게 구하는 방법에 대해서 살펴보았다.

| 1. |
M.C. Manning, et al., Pharmaceutical Research, 27, 575 (2010). |
| 2. |
M. Weichel, et al.,BioProcess Int.,6,42 (2008). |
| 3. |
H.J. Hinz, et al., Pure and Applied Chemistry,65,947 (1993) |
| 4. |
P. Garidel, et al.,Biotechnology Journal,3,1201 (2008) |
| 5. |
P. Garidel, et al., Spectroscopy Europe, 20, 13 (2013) |
|